Тепловые процессы (часть 2)
Равновесные состояния физических систем можно изображать графически (фазовая диаграмма) при различных значениях параметров, определяющих эти состояния,— температуры Т, давления Р, концентрации С, а в ряде случаев и в зависимости от других параметров — объема V, напряженности электрического Е и магнитного n полей и др. (рис. 3.4).
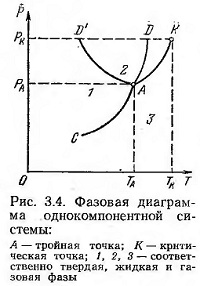
Для простоты изложения основные понятия о физических явлениях, происходящих при фазовых превращениях, рассмотрим на примере однокомпонентных систем, для которых кривая фазового перехода описывается уравнением Клайперона—Клаузиса

где λ — теплота фазового превращения; ΔV — разность объемов фаз.
Плавление твердого тела начинается при определенной температуре Тпл, постоянной для данного давления.
Подведенная теплота увеличивает энергию колебания атомов, что проявляется в повышении температуры. С возрастанием температуры увеличивается концентрация вакансий в кристаллической решетке. При плавлении концентрация вакансий достигает критического значения и решетка распадается на легкоподвижные субмикроскопические области, беспорядочно ориентированные относительно друг друга. В этот момент теплота, подводимая извне, не увеличивает энергию колебаний атомов и температура остается постоянной. Дальнейший подвод теплоты к полностью расплавившемуся телу вновь приводит к повышению энергии колебаний атомов (или молекул) и к повышению температуры жидкости. Для большинства веществ при увеличении давления температура плавления повышается (см. рис. 3.4, кривая АD). Для некоторых веществ (вода, галлий, висмут и др.) плотность жидкой фазы больше, чем твердой. Температура плавления этих веществ понижается, начиная с тройной точки (см. рис. 3.4, кривая АD').
Аморфные твердые вещества (стекло, битумы, смола и др.) не имеют определенной температуры плавления и при нагреве постепенно размягчаются в широком диапазоне температур.
Процесс парообразования по молекулярно-кинетическим представлениям — непрерывный процесс вылета молекул за пределы конденсированной фазы в результате теплового движения. Он сопровождается поглощением теплоты. Сублимация возможна во всем диапазоне температур и давлений, при котором совместно существуют твердая и газообразная фазы. Подводимая теплота затрачивается на преодоление сил связи между частицами твердого тела и на отрыв частиц с поверхности кристалла. Кривая равновесия твердое тело — пар называется кривой сублимации (см. рис. 3.4, кривая АС). Скорость сублимации (т. е. масса вещества, сублимирующая в единицу времени) связана с температурой поверхности и давлением насыщенного пара.
- Тепловые процессы (часть 1)
- Термохимические процессы (часть 2)
- Термохимические процессы (часть 1)
- Процесс выщелачивания (часть 2)
- Процесс выщелачивания (часть 1)
- Процесс растворения (часть 2)
- Процесс растворения (часть 1)
- Химия геотехнологических процессов (часть 2)
- Химия геотехнологических процессов (часть 1)
- Физико-химические основы геотехнологических процессов
- Геолого-гидрогеологические работы (часть 4)
- Геолого-гидрогеологические работы (часть 3)
- Геолого-гидрогеологические работы (часть 2)
- Геолого-гидрогеологические работы (часть 1)
- Методика исследований месторождения (часть 5)
- Методика исследований месторождения (часть 4)
- Методика исследований месторождения (часть 3)
- Методика исследований месторождения (часть 2)
- Методика исследований месторождения (часть 1)
- Требования геотехнологических методов
- Физико-геологические факторы и эффективность обработки (часть 2)
- Физико-геологические факторы и эффективность обработки (часть 1)
- Горная среда, горная порода, полезные ископаемые (часть 5)
- Горная среда, горная порода, полезные ископаемые (часть 4)
- Горная среда, горная порода, полезные ископаемые (часть 3)
- Горная среда, горная порода, полезные ископаемые (часть 2)
- Горная среда, горная порода, полезные ископаемые (часть 1)
- Физико-геологические основы геотехнологии
- Основные направления развития геотехнологии (часть 2)
- Основные направления развития геотехнологии (часть 1)

