Процесс растворения (часть 1)
При растворении всегда имеется перемещение жидкой фазы относительно твердой поверхности растворяемого вещества. Даже в случае отсутствия внешних причин, вызывающих движение жидкой фазы, происходит естественная конвекция жидкости, обусловленная тем, что плотность жидкой фазы неодинакова в разных точках внутри раствора. Независимо от характера движения жидкости у границы раздела фаз всегда существует пограничный слой жидкости, который оказывает сопротивление диффузии частиц растворимого вещества в массу раствора.
Скорость диффузионного процесса растворения определяется разностью концентрации растворяемого вещества на контакте между пограничным слоем насыщенного рассола, образующимся на поверхности растворения, и общей массой растворителя. По мере повышения концентрации растворяемого вещества в жидкой фазе скорость растворения уменьшается по логарифмическому закону, т. е. она пропорциональна насыщенности раствора (разности между растворимостью и текущей концентрацией растворенного вещества). Под скоростью растворения понимается количество соли, растворяемой в единицу времени с единицы поверхности (массовая скорость растворения), или расстояние, на .которое распространяется растворение (линейная скорость растворения). Как показали многочисленные исследования, скорость растворения не является постоянной даже при постоянстве температуры, начальной концентрации и т. д. Следовательно, одного уравнения скорости недостаточно, чтобы описать явления, происходящие при растворении.
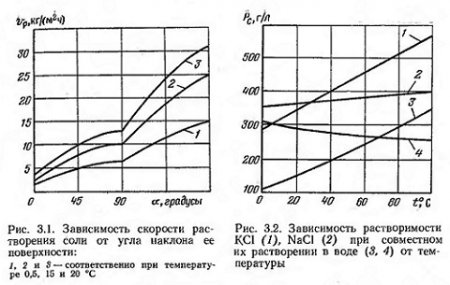
Справедливо возникает вопрос, какие же еще явления должны быть присоединены к явлениям диффузии, если считать, что условия химического взаимодействия на скорость растворения влияния не оказывают. В результате изучения растворимости каменной соли П. А. Кулле пришел к выводу, что для точного описания процесса должны учитываться гидродинамические параметры движения жидкости, зависящие от таких важных факторов, как ее вязкость и влияние силы тяжести. Было отмечено, что скорость растворения в значительной степени зависит от угла наклона поверхности соли и температуры (рис. 3.1). В зависимости от изменения температуры воды растворимость галита и сильвина изменяется различно (рис. 3.2). При совместном их растворении в растворе наблюдается определенное суммарное их количество и определенное количество каждого из них в отдельности.
- Химия геотехнологических процессов (часть 2)
- Химия геотехнологических процессов (часть 1)
- Физико-химические основы геотехнологических процессов
- Геолого-гидрогеологические работы (часть 4)
- Геолого-гидрогеологические работы (часть 3)
- Геолого-гидрогеологические работы (часть 2)
- Геолого-гидрогеологические работы (часть 1)
- Методика исследований месторождения (часть 5)
- Методика исследований месторождения (часть 4)
- Методика исследований месторождения (часть 3)
- Методика исследований месторождения (часть 2)
- Методика исследований месторождения (часть 1)
- Требования геотехнологических методов
- Физико-геологические факторы и эффективность обработки (часть 2)
- Физико-геологические факторы и эффективность обработки (часть 1)
- Горная среда, горная порода, полезные ископаемые (часть 5)
- Горная среда, горная порода, полезные ископаемые (часть 4)
- Горная среда, горная порода, полезные ископаемые (часть 3)
- Горная среда, горная порода, полезные ископаемые (часть 2)
- Горная среда, горная порода, полезные ископаемые (часть 1)
- Физико-геологические основы геотехнологии
- Основные направления развития геотехнологии (часть 2)
- Основные направления развития геотехнологии (часть 1)
- Основные понятия и определения (часть 3)
- Основные понятия и определения (часть 2)
- Основные понятия и определения (часть 1)
- Особенности геотехнологических методов и их классификация
- НТР в горном деле и геотехнологии
- О месте геотехнологии в системе горных наук
- Как учесть будущую технику при заказе кухни: пошаговое руководство