Процесс растворения (часть 3)
В случае, когда раствор недонасыщен хлористым калием и его состав соответствует точке f кривая при охлаждении пойдет по линии ^^, параллельной оси ординат, до пересечения с политермой с1с6. При этом произойдет выпадение из раствора хлористого натрия. При последующем охлаждении будет выпадать (по кривой qm6) только хлористый калий. В этой диаграмме - суть процесса обогащения сильвинита горячим маточным раствором.
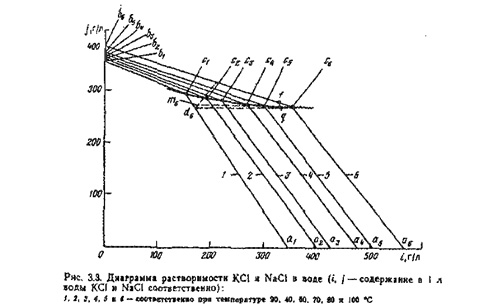
Кристаллизация соли - процесс, обратный растворению, наступает, когда раствор при данной температуре перенасыщен солью. Кристаллизация может происходить вследствие испарения части растворителя или понижения температуры насыщенного раствора. Скорость процесса кристаллизации зависит от присутствия в растворе зародышей кристаллов, быстроты охлаждения раствора, перемешивания, высокой начальной температуры, чистоты рассола.
Природа процесса растворения солей очень сложна. Прежде всего поверхность, на которой происходит процесс растворения, непрерывно изменяется, поверхность же растворимых частиц вообще трудно определять, а включение нерастворимых компонентов осложняет процесс растворения. Все это затрудняет расчет параметров растворения в сложных гидродинамических условиях.
- Процесс растворения (часть 2)
- Процесс растворения (часть 1)
- Химия геотехнологических процессов (часть 6)
- Химия геотехнологических процессов (часть 5)
- Химия геотехнологических процессов (часть 4)
- Химия геотехнологических процессов (часть 3)
- Химия геотехнологических процессов (часть 2)
- Химия геотехнологических процессов (часть 1)
- Физико-химические основы геотехнологических процессов
- Геолого-гидрологические работы на предприятиях, работающих ФХМГ (часть 4)
- Геолого-гидрологические работы на предприятиях, работающих ФХМГ (часть 3)
- Геолого-гидрологические работы на предприятиях, работающих ФХМГ (часть 2)
- Геолого-гидрологические работы на предприятиях, работающих ФХМГ (часть 1)
- Основные технологические зависимости
- Оптимизации параметров геотехнологического производства (часть 2)
- Оптимизации параметров геотехнологического производства (часть 1)
- Методика расчета основных параметров добычи
- Анализ экономики вскрытий месторождения (часть 2)
- Анализ экономики вскрытий месторождения (часть 1)
- Расчет себестоимости полезного ископаемого
- Производительность труда и себестоимость добычи
- Структура капитальных вложений
- Гидрогеологические исследования (часть 2)
- Методика выбора метода разработки (часть 2)
- Гидрогеологические исследования (часть 1)
- Исследование месторождения при подготовке его к отработке ФХМГ (часть 3)
- Исследование месторождения при подготовке его к отработке ФХМГ (часть 2)
- Исследование месторождения при подготовке его к отработке ФХМГ (часть 1)
- Методика выбора метода разработки (часть 1)
- Требования методов ФХГ к физико-геологической обстановке

