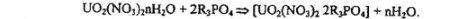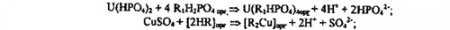Жидкостная экстракция (часть 2)
Главный недостаток - пожаро- и взрывоопасность, поскольку разбавители (керосин, ацетон, бензол и т.п.) - горючие вещества. Ведутся работы по поискам негорючих разбавителей. Таковым, например, является перхлорэтилен С2Н2Сl2, уже получивший применение в зарубежной практике.
Экстрагенты. В технологии жидкостной экстракции они подразделяются на три группы: 1) нейтральные экстрагенты; 2) органические кислоты; 3) органические амины и четвертичные аммониевые основания.
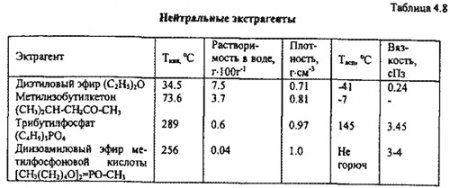
Нейтральные экстрагенты, например трибутилфосфат и др., действуют по сольватному механизму с вытеснением воды из внутренней координационной сферы комплекса:
Эти экстрагенты действуют преимущественно в азотнокислых средах. Иногда эта реакция называется реакцией молекулярного присоединения. Разбавителем служит керосин. Реэкстракцию проводят горячей водов (табл. 4.8).
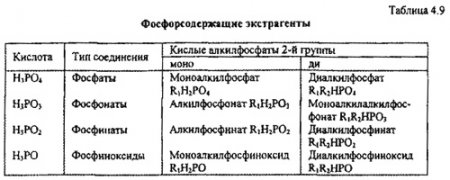
Из органических кислот в технологии урана большое значение имеют фосфорсодержащие органические экстрагенты на основе замещения водорода в этих соединениях (табл. 4.9).
Для кислых алкилфосфатов характерны катионообменные реакции с вытеснением иона водорода в водную фазу:
Органические производные аммиака NH3: первичные RNH2 вторичные R1R2NH и третичные R1R2R3N в кислой среде подобно аммиаку образуют соль амина: 2R3N + H2SO4 <> [(R3NH)2SO4], и являются анионообменниками: (RsNH)2SO4орг + [UO2(SO4)2]2 <> [(R3NH)2UO2(SO4)2]орг + SО4в2-.
Четвертичные аммониевые основания и их соли ведут себя подобно иону аммония NH4+ также являясь анионообменниками в любых средах: R4NCI + Au(CN)2 <> R4N[Au(CN)2] + Сl.
- Жидкостная экстракция (часть 1)
- Биосорбционная флотация
- Флотационные способы отделения сорбентов (часть 3)
- Флотационные способы отделения сорбентов (часть 2)
- Флотационные способы отделения сорбентов (часть 1)
- Десорбция (часть 3)
- Десорбция (часть 2)
- Десорбция (часть 1)
- Сорбционные методы извлечения металлов (часть 3)
- Сорбционные методы извлечения металлов (часть 2)
- Сорбционные методы извлечения металлов (часть 1)
- Гальванохимическое извлечение металлов (часть 2)
- Гальванохимическое извлечение металлов (часть 1)
- Цементация золота и серебра
- Цементация (часть 2)
- Цементация (часть 1)
- Флотация осадков
- Коагуляция и флокуляция
- Сгущение и фильтрование
- Химическое осаждение металлов (часть 2)
- Химическое осаждение металлов (часть 1)
- Переработка продуктивных растворов
- Продуктивные растворы выщелачивания (часть 2)
- Продуктивные растворы выщелачивания (часть 1)
- Пульпы скважинной гидродобычи. Рассолы. Расплавы (часть 2)
- Пульпы скважинной гидродобычи. Рассолы. Расплавы (часть 1)
- Продукты физико-химической геотехнологии
- Процесс подъема полезного ископаемого (часть 3)
- Процесс подъема полезного ископаемого (часть 2)
- Процесс подъема полезного ископаемого (часть 1)