Процесс растворения (часть 2)
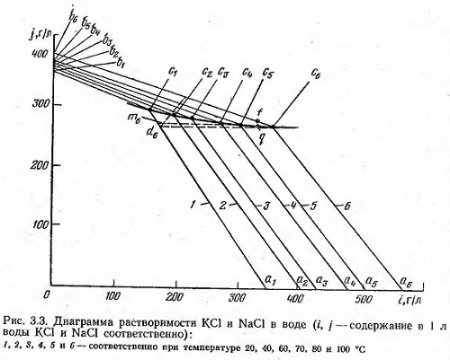
На рис. 3.3 приведена диаграмма растворимости в системе КСl—NаСl—Н2O.
Точки a1—a6 на оси абсцисс и b1—b6 на оси ординат диаграммы соответствуют содержанию хлористого калия и натрия в граммах в 1 л воды при различной температуре раствора. При постепенном добавлении к указанным растворам хлористого натрия или хлористого калия точки a1—а6 или b1—b6 переместятся по линиям диаграммы соответственно в точки c1—с6. Линии, проведенные из точек а1, а2, а6 и из точек b1, b2, b3,... b6 пересекутся в точках c1, с2,...c6, которые и будут соответствовать растворам, насыщенным одновременно хлористым калием и натрием при соответствующей температуре. Растворы, насыщенные обеими солями, не будут растворять этих солей. На линиях (изотермах) a1c1, a2c2,...a6c6 располагаются точки, соответствующие растворам, которые насыщены хлористым калием и не насыщены хлористым натрием, а на изотермах b1c1, b2с2,... b6c6 — точки, соответствующие растворам, насыщенным натрием и не насыщенным хлористым калием. На линии c1с6 (политерма) располагаются точки, соответствующие рассолам, насыщенным обеими солями при температуре от 20 до 100°С. Если раствор, соответствующий точке d6 (раствор насыщения обеими солями при температуре 100°С) охладить до 20°С, то состав его будет изменяться по кривой кристаллизации с6d6, параллельной оси абсцисс, так как соотношение воды и хлористого натрия остается в этом случае неизменным. Раствор, соответствующий точке d6 насыщен хлористым калием, но не насыщен хлористым натрием при температуре 20°С. Поэтому при охлаждении раствора от 100 до 20°С часть хлористого калия выпадает в осадок. Если раствор, соответствующий точке d6 снова нагреть до 100°С, то он растворит недостающую часть хлористого калия. Содержание хлористого натрия в растворе останется неизменным.
Приведенная на рис. 3.3 диаграмма растворимости хорошо иллюстрирует процесс получения хлористого калия. Однако в производственных условиях этот процесс несколько осложняется, в сильвините хлористого натрия значительно больше, чем хлористого калия, поэтому в связи с большим растворением хлористого натрия (содержание раствора придет не к равновесной точке с6 (при температуре 100°С), а пойдет по кривой d6c6 и будет происходить растворение хлористого калия, а состав раствора будет перемещаться по линии b6c6. В случае, когда раствор недонасыщен хлористым калием и его состав соответствует точке f, кривая при охлаждении пойдет по линии fd, параллельной оси ординат, до пересечения с политермой c1c6. При этом произойдет выпадение из раствора хлористого натрия. При последующем охлаждении будет выпадать (по кривой dm6) только хлористый калий. В этой диаграмме — суть процесса обогащения сильвинита горячим маточным раствором.
Кристаллизация соли — процесс, обратный растворению, наступает, когда раствор при данной температуре перенасыщен солью. Кристаллизация может происходить вследствие испарения части растворителя или понижения температуры насыщенного раствора. Скорость процесса кристаллизации зависит от присутствия в растворе зародышей кристаллов, быстроты охлаждения раствора, перемешивания, высокой' начальной температуры, чистоты рассола.
Природа процесса растворения солей очень сложна. Прежде всего поверхность, на которой происходит процесс растворения, непрерывно изменяется, поверхность же растворимых частиц вообще трудно определять, а включение нерастворимых компонентов осложняет процесс растворения. Все это затрудняет исследование теоретических данных для расчета параметров растворения в сложных гидродинамических условиях.
- Процесс растворения (часть 1)
- Химия геотехнологических процессов (часть 2)
- Химия геотехнологических процессов (часть 1)
- Физико-химические основы геотехнологических процессов
- Геолого-гидрогеологические работы (часть 4)
- Геолого-гидрогеологические работы (часть 3)
- Геолого-гидрогеологические работы (часть 2)
- Геолого-гидрогеологические работы (часть 1)
- Методика исследований месторождения (часть 5)
- Методика исследований месторождения (часть 4)
- Методика исследований месторождения (часть 3)
- Методика исследований месторождения (часть 2)
- Методика исследований месторождения (часть 1)
- Требования геотехнологических методов
- Физико-геологические факторы и эффективность обработки (часть 2)
- Физико-геологические факторы и эффективность обработки (часть 1)
- Горная среда, горная порода, полезные ископаемые (часть 5)
- Горная среда, горная порода, полезные ископаемые (часть 4)
- Горная среда, горная порода, полезные ископаемые (часть 3)
- Горная среда, горная порода, полезные ископаемые (часть 2)
- Горная среда, горная порода, полезные ископаемые (часть 1)
- Физико-геологические основы геотехнологии
- Основные направления развития геотехнологии (часть 2)
- Основные направления развития геотехнологии (часть 1)
- Основные понятия и определения (часть 3)
- Основные понятия и определения (часть 2)
- Основные понятия и определения (часть 1)
- Особенности геотехнологических методов и их классификация
- НТР в горном деле и геотехнологии
- О месте геотехнологии в системе горных наук